Ronapreve® (casirivimab - imdevimab) 120 mg/mL : Risque d'erreur médicamenteuse et modification de posologie
1/ Des erreurs d’administration sont survenues avec l’association casirivimab et imdevimab 120 mg/mL (accèsprécoce et ATU de cohorte) pour le traitement ou la prévention du COVID-19 chez les patients à très haut risque.
Ces erreurs résultent d'uneconfusion entre les volumes des contenants et des contenus des flacons de casirivimab et imdevimab mentionnés sur l’étui :
-flacon unidose de 6 mL (vert ou bleu) = 2,5 mL de solution = 300 mg d’Ac
-flacon multidose de 20 mL (gris ou blanc) = 11,1 mL de solution = 1332 mg d’Ac
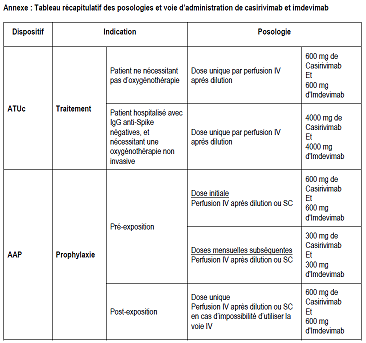
2/ Modification de la posologie dans le traitement curatif chez les patients non oxygénoréquérants :
L’ANSM informe de la modification de la posologie recommandée pour le traitement de la maladie COVID-19 des patients ne nécessitant pas d’oxygénothérapie. La dose recommandée dans cette indication est dorénavant d’une dose unique de 600 mg de Casirivimab et 600 mg d’Imdevimab par perfusionIV (résumé des doses par indication ci-dessous).
NB : Les présentations actuellement disponibles sont étiquetées en langue anglaise et contiennent une notice également rédigée en anglais. Ces notices ne contiennent pas toutes les informations correspondant aux indications de l'ATUc et des AAP octroyées en France. L’ANSM demande donc de ne pas tenir compte des mentions figurant actuellement en anglais sur les conditionnements primaires et secondaires (étiquetage et notice) mais de se référer au RCP et à la notice patient rédigés en français établis dans le cadre de l'ATUc et des AAP.
Texte intégral - ANSM - 30/11/2021